نجح فريق دولي من الباحثين بصنع مركبٍ مستقرٍ ثيرموديناميكيًا يتكون من الصوديوم وغاز الهيليوم النبيل (Na2He) وله بنية من نوع الفلورايت وهو مستقر تحت الضغوط العالية. وقد نشرت هذه النتائج في مجلة (Nature Chemistry).

***صورة مصغرة لداخل خلية سندان الماس (Diamond anvil cell) عالي الضغط في ضوء منعكس ومنتقل عند ضغط 140 GPa بعد تسخين الليزر إلى أكثر من 1,500 كلفن. هذه العينة، والتي تتألف من خليط من tI19 Na وNa2He، على اتصال مع وسط الهيليوم الذي يرى كمنطقة شفافة قرب حافة الطوق.
وقد قال الباحثون: “الهيليوم هو ثاني أكثر العناصر انتشارًا في الكون من بعد الهيدروجين، وهو متواجد بكميات كبيرة في النجوم العادية والكواكب الغازية العملاقة مثل المشتري وزحل.”
وأضافوا: “يعتبر كل من الهيليوم والنيون أكثر العناصر خمولاً في الجدول الدوري. يمكن فهم ذلك بأن قابلية تأين ذرة الهيليوم هي الأعلى من بين جميع العناصر وألفتها الإلكترونية تساوي صفر.”
وقال البروفيسور أليكس بولديريف (Alex Boldyrev)، المشارك في الدراسة من جامعة ولاية يوتا: “يظهر أول الغازات النبيلة الهيليوم بنيةً إلكترونيةً مستقرةً ومغلقةً تمامًا، مما لا يدع مجالاً للإرتباط.”
أجرى البروفيسور بولديريف وزملاؤه بحثًا حاسوبيًا واسع النطاق عن المركبات المستقرة الممكنة للهيليوم مع مجموعة متنوعة من العناصر (هيدروجين، وأوكسجين، وفلور، وصوديوم، وبوتاسيوم، ومغنيسيوم، وليثيوم، وروبيديوم، وسيزيوم ..الخ).
وجدوا أن الصوديوم فقط قادرٌ على تكوين مركب مستقر مع الهيليوم عند ضغوط يمكن الوصول إليها في التجارب.
حيث قال الباحثون: ” لقد وجدنا مركبًا جديدًا، هو Na2He، له إنثالبي أقل من خليط عنصري الصوديوم والهيليوم، أو أي خليطٍ آخرٍ، عند ضغط أعلى من 160 GPa (كيكاباسكال).”
ومن المتوقع أن يكون التفاعل باعثًا للحرارة عند الضغوط الأعلى من 160 GPa، وبإنثالبي كبير يصل إلى 0.51- eV (إلكترون فولت) عند ضغط 500 GPa.
تشير حسابات فونون (Phonon calculations) بوضوح إلى استقرارية Na2He الديناميكية فوق ضغط 100 GPa. ما يعني أن المركب عندما يتشكل، فإنه يمكن أن تتم تسقية هذا الطور إلى أقل من 100 GPa، ولكن عند ضغط 50 GPa أو أقل، سيكون المركب غير مستقر ديناميكيًا وغير قابل للتسقية إلى الظروف المحيطة.
بعدها أكد الفريق بالتجربة أن الصوديوم يرتبط بسهولة مع الهيليوم تحت ضغطٍ عالٍ لتكوين مركب Na2He الغريب.
وقال البروفيسور بولديريف: “كانت النتائج غير متوقعة إلى حدٍ كبيرٍ، حيث أننا ناضلنا لأكثر من عامين لإقناع المراجعين والمحررين العلميين بنشر نتائجنا.”
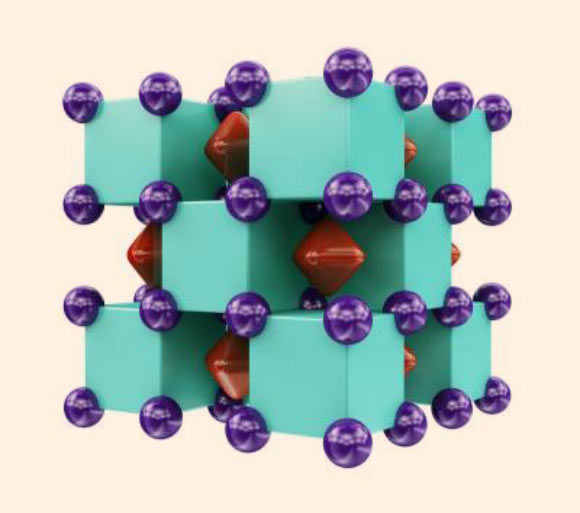
***التركيب البلوري لمركب Na2H: تمثل الكرات البنفسجية ذرات الصوديوم، وهي داخل المكعبات الخضراء التي تمثل ذرات الهيليوم. بينما تشير المناطق الحمراء داخل فراغات التركيب إلى أماكن تواجد أزواج الإلكترونات.
وُجِد في البداية أن المركب يتكون من مكعبات Na8، والتي تشغل ذرات الهيليوم نصفها بينما النصف الآخر فارغ.
وقال البروفيسور بولديريف: “ومع ذلك، عندما أجرينا تحليل الترابط الكيميائي لهذه البنية، وجدنا أن كل مكعب فارغ يحتوي في الواقع على آصرة ثمانية المركز ثنائية الإلكترون. وهذه الآصرة هي المسؤولة عن استقرارية هذا المركب الفاتن.”
ويتوقع الباحثون أيضا وجود مركب Na2HeO وببنية مماثلة عند ضغوط أعلى من 15 GPa.
ترجمة: عبدالله الهنداوي
تدقيق علمي: Muhammad Basim
تدقيق لغوي: Tabarek A. Abdulabbas
تصميم: Tabarek A. Abdulabbas
المصدر: هنا
 الباحثون العراقيون Iraqi Researchers
الباحثون العراقيون Iraqi Researchers